DOI: 10.35381/s.v.v3i1.446
Composición y diversidad de la comunidad de fitoplancton en dos sectores contiguos de la bahía de Manta, Ecuador
Composition and diversity of the phytoplankton community in two adjacent sectors of the bay of Manta, Ecuador
Luber Javier Quijije López
Universidad Laica Eloy Alfaro de Manabí, Manta
Ecuador
https://orcid.org/0000-0003-4153-7261
José Javier Alío Mingo
Universidad Laica Eloy Alfaro de Manabí, Manta
Ecuador
https://orcid.org/0000-0003-2210-6802
Juan Pablo Napa España
Universidad Laica Eloy Alfaro de Manabí, Manta
Ecuador
https://orcid.org/0000-0003-0531-9048
Darío Olivio Del Valle Calderón
Universidad Laica Eloy Alfaro de Manabí, Manta
Ecuador
https://orcid.org/0000-0001-8879-4914
Recibido: 6 de septiembre de 2019
Aprobado: 29 de septiembre de 2019
RESUMEN
El fitoplancton constituye la base de las cadenas tróficas de muchos ecosistemas acuáticos y es susceptible a alteraciones ambientales causadas por fenómenos físicos, biológicos o químicos. En este sentido, el estudio de los parámetros que potencialmente afectan al fitoplancton permitirá un mejor control de los ambientes donde se desarrollan importantes actividades económicas como la pesca, el turismo, entre otras. El propósito del presente estudio fue evaluar la composición y diversidad del fitoplancton en dos sectores en los cuales está dividida la bahía de Manta, sometidos a distintas nivel de impacto ambiental, el Murcielago (M) y los Esteros (E). El estudio se realizó entre julio y agosto del 2017 tomando muestras de fitoplancton una vez a la semana a las 21:00 y a las 08:00 con una red con malla de luz de 50µm. Los arrastres se hicieron desde un bote en transeptos de 300 m de longitud y paralelos a la costa; el primero a 1,8 km del perfil costero y los otros dos a 2 km y 2,2 km, respectivamente. El sector M está más expuesto a las corrientes marinas predominantes y mostró mayor variabilidad térmica. El sector E recibe la descarga de dos ríos y se lo considera más contaminado que el M. Se encontró una correlación positiva entre la temperatura y la abundancia de fitoplancton en M. El fitoplancton estuvo compuesto por 32 familias: 22 de Bacillariophyta, 4 de Dinoflagellata, 4 Haptophytas y 1 Chlorophyta. En M, el fitoplancton fue más abundante (promedio 610,7 ± 780,1 cel ml-1) y diverso (H’=3,27), en comparación con E, donde la abundancia promedio fue 13,6 ± 4,8 cel ml-1 y la diversidad (H’) fue 3,1. La menor abundancia y diversidad en el sector E se atribuyen a un mayor deterioro ambiental y se considera que las familias presentes allí pudieran servir de indicadoras de contaminación ambiental; en particular las diatomeas Chaetocerotaceae, Lithodesmiaceae, Rhopalodiaceae, Melosiraceae y los dinoflagelados Ceratiaceae.}
Descriptores: Contaminación; Temperatura; Abundancia; Especies Indicadoras; Manabí.
ABSTRACT
Phytoplankton is the basis of the food chains in many aquatic ecosystems and is susceptible to environmental changes caused by physical, biological or chemical parameters. In this sense, the study of the parameters that potentially affect the phytoplankton will allow better control of environments where there are important economic activities under development such as fishing, tourism, among others. The purpose of the present study was to evaluate the composition and diversity of the phytoplankton in two sectors which divide Manta Bay, subjected to different level of environmental impact, Muricielago (M) and Esteros (E). The study was conducted between July and August of 2017 taking phytoplankton samples once a week at 21:00 and 08:00 with a net made with 50 µm mesh size. Tows were made from a boat in three transepts of 300 m long parallel to the coast, the first located at 1.8 km off shore and the other two at 2 km and 2.2 km offshore, respectively. Sector M is predominantly more exposed to the ocean currents and showed greater thermal variability. Sector E receives the discharge of two rivers and was considered more polluted than M. Found a positive correlation between temperature and the abundance of phytoplankton in M. Phytoplankton was composed of 32 families: 22 Bacillariophyta, 4 Dinoflagellata, 4 Haptophyta and 1 Chlorophyta. In M, phytoplankton was most abundant (average ± 610,7 780,1 cel ml-1) and diverse (H'= 3, 27), compared to E, where abundance was in average 13.6 ± 4.8 cel ml-1 and diversity (H') was 3.1. The lower diversity and abundance in sector E, was attributed to a greater environmental deterioration and it was considered that the families present there could serve as indicators of environmental pollution; in particular: Chaetocerotaceae, Lithodesmiaceae, Rhopalodiaceae, Melosiraceae diatoms and dinoflagellates Ceratiaceae.
Descriptors: Pollution; Temperature; Abundance; Indicator species; Manabí.
INTRODUCCIÓN
En los sistemas acuáticos marinos encontramos organismos que viven suspendidos en el cuerpo de agua y por su diminuto tamaño son arrastrados por los movimientos de las corrientes. A estos se los denomina plancton, y viven en aguas continentales como también oceánicas. (Lemus, J. L. C., Torres-García, M., & Mondragón, M. F, 1997). Su gran abundancia y diversidad de especies dependen del tiempo, espacio y de las condiciones óptimas para su proliferación (Molina-Astudillo et al., 2005).
Los organismos marinos dependen de los carbonatos y bicarbonatos para el proceso de la fotosíntesis (Antonio Low Pfeng & Edward M. Peters Recagno, 2014). En el océano el carbono se combina para producir carbonato de calcio, removiendo el CO2 del agua de mar y originando que el pH baje significativamente para revertir la formación de CO2 mediante el ciclo normal del agua (F.F. Pérez & F. Fraga, 1885).
El conocer sobre el plancton es de vital importancia para la comprobación de impactos negativos o positivos, ya que los cambios biológicos, físicos o químicos que se den en el ecosistema, se verán reflejados en la composición, distribución y abundancia de este mismo (Prado M & Bucheli R, 2011).
Por otro lado, la productividad pesquera depende de parámetros abióticos como cambios de flujo de energía, corrientes, turbidez, concentración de oxígeno disuelto, disposición de alimento etc. (Prado, Bucheli, & Caldeón, 2016); estas variables establecerán la abundancia de plancton, estableciendo la relación entre la transferencia de energía de los diferentes organismos y la disposición de alimento (Naranjo & Tapia, 2013).
El Ecuador es un país importante para el sector pesquero, turístico y artesanal. El Cantón Manta es uno de los más poblados de la provincia de Manabí, presentando mayor concentración de habitantes como consecuencia de la industrialización acelerada en los últimos años, siendo el recurso pesquero y el turismo los principales factores para el crecimiento económico (Nuñez, Elizabeth, Zambrano, & Monica, 2010).
En los alrededores de las costas de Manta están ubicados bancos, hoteles y áreas comerciales del Cantón, puesto que presentan alcantarillas semisubterráneas que vierten sus aguas hacia el mar, ocasionando que las aguas residuales generadas en la ciudad provoquen un desequilibrio general dentro del ecosistema marino y terrestre (Delgado, 2007).
En esta zona litoral existen pocos estudios de las características de sus comunidades y de los impactos que sobre ellas ejercen los fenómenos de contaminación ambiental. Por esta razón el objetivo de este trabajo es determinar la composición y abundancia del fitoplancton en dos ambientes de la bahía de Manta, contiguas al puerto de Manta: frente a la playa el Murciélago y frente a la comunidad de los Esteros.
MATERIALES Y MÉTODOS
Área de Estudio
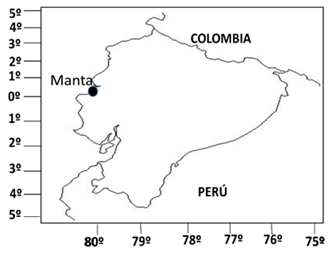
Los sitios de estudio fueron el sector de la bahía de Manta frente a la playa el Murciélago (Latitud de 0° 45' 00.79" S y Longitud de 80° 29' 59.11" O), y el sector de dicha bahía frente a la comunidad de los Esteros (Latitud de 0° 56’ 19.5” S y Longitud 80 °42’ 40.1” W). Estos sectores están divididos físicamente por el malecón del Puerto de Manta (Ecuador). La playa Murciélago se encuentra en el extremo noroeste de la ciudad con una extensión aproximadamente de 1.700 m lineales de playa, que representa a un 0,49% del total de playa de la provincia, presenta un clima subtropical seco (Telégrafo, 2016). En el sector de Barbasquillo al oeste de la playa, se encuentra un emisor de la Empresa Publica Aguas de Manta que descarga aguas servidas directamente al mar.
Los ríos Manta y Muerto descargan al sector de los Esteros. El río Manta recibe las aguas de escorrentía del sector oeste de la ciudad, así como los efluentes de las lagunas de tratamiento de aguas servidas, ubicadas en el sector San Juan, al oeste de Manta (Pedro Orellana Izquierdo, 2008); (El Telégrafo, 2015) (Telégrafo, 2017). El río Muerto recibe las aguas de escorrentía del sector este de la ciudad y posiblemente descargas clandestinas de efluentes de aguas servidas.


Mapa del sitio del muestro
Figura 1.
FASE DE CAMPO
Los muestreos se realizaron mediante una embarcación de fibra de 6,4 metros de eslora y 2 metros de manga, con motor fuera de borda. Durante el periodo comprendido entre julio y agosto del 2017, se realizaron 32 muestreos en total, 16 para el sector de Playa Murciélago y 16 para el sector de los Esteros durante 8 semanas los días jueves (20:00 horas) y viernes (8:00 horas) dentro de la zona nerítica del sector.
Las muestras se tomaron en tres transeptos paralelos a la costa de 300 m cada uno; el primero a 1,8 km de la costa y los otros dos a 300 y 600 m de distancia del primero, respectivamente.
Las muestras de fitoplancton se obtuvieron utilizando una red cónica con diámetro en la boca de 29,7 cm y malla de 55 µm, remolcada mediante un cabo de 10 m con grilletes tipo mosquetón en los extremos, manteniendo una velocidad constante de 3.6 km/h. Las muestras fueron recolectadas al cabo de 5 minutos medidos por cronometro. La distancia y coordenadas de la recolecta se midió por la aplicación Fields Area Measure PRO versión 3.6.8; la aplicación Fishing Points versión 2.6.4, media la velocidad (Kn) y también corroboraba puntos de inicio y fin del arrastre. Los volúmenes de muestra obtenida fueron de 500 ml y se colocaron en botellas pláticas de 750 ml previamente etiquetadas y se fijaban con 1 ml de solución de formaldehido al 3% por cada 100 ml de agua de mar. El análisis de las muestras se efectuó en el laboratorio de Biología de la Universidad Laica Eloy Alfaro de Manabí, de la Facultad Ciencias del Mar en Manta. También se registró datos de temperatura superficial de las zonas, tomadas de multiparametro marca “Consort” modelo C6020.
FASE DE LABORATORIO
Para determinar abundancia de fitoplancton (cel /ml) se utilizó la Cámara de Recuento Sedgewick-Rafter, (Soler et al., 2012), tomando 1 ml de muestra, la cual fue previamente estandarizada a un volumen de 500 ml.
La diversidad de fitoplancton se estimó tomando en 1 ml de muestra de agua y observada bajo un microscopio las características morfológicas e identificando los organismos hasta el menor taxón posible. La identificación de organismos fue reflejada mediante la guía de Jimenez (1983).
ANALISIS DE DATOS
La diversidad se calculó de acuerdo al índice H’ (Shannon, and Weaver, 1949) en base a la siguiente ecuación:
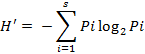
Dónde:
H’= índice de diversidad, Pi= proporción de individuos de la especie, I= respecto al total de individuos (es decir la abundancia relativa de la especie N), Log2= logaritmo de base 2.
La diversidad máxima (Hmax) se estimó en base al Log2 del número de familias y el índice de equidad de Pielou (PIELOU, 1969) como H’ / Hmax .
ANÁLISIS ESTADÍSTICO
Los promedios de temperatura y abundancia fueron comparados mediante pruebas t de Student, verificando previamente la homogeneidad de las varianzas. Cuando estas fueron heterogéneas los datos se transformaron a logaritmo decimal. La asociación entre temperatura y abundancia de fitoplancton se midió por medio del coeficiente de correlación de Pearson (Sokal y Rohlf, 2011) .
RESULTADOS
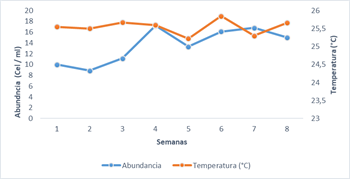
El ambiente en el sector Los Esteros mostró mayor estabilidad térmica, con cambios en la temperatura de 0,6 ºC en el intervalo 25,3 a 25,85 ºC durante el periodo evaluado (Fig. 2). No se encontró diferencia significativa en la temperatura promedio de día o de noche.
La abundancia de fitoplancton varió significativamente entre el día (16,9 ± 3,8 cel ml-1) y la noche (10,2 ± 3,1 cel ml-1) (prueba t de Student, p<0,001). No se observó una correlación significativa entre este parámetro y los cambios térmicos (Fig. 2.). Sin embargo, se observa una tendencia en la abundancia de fitoplancton a elevarse cuando la temperatura sube.
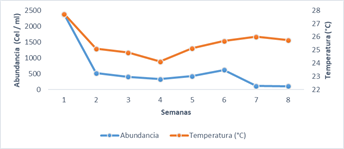
El ambiente en el sector el Murciélago mostro variabilidad térmica, con cambios en la temperatura de 4,7 ºC en el intervalo 23,7 a 28,3 ºC durante el periodo evaluado (Fig. 3). No se encontró diferencia significativa en la temperatura promedio de día o de noche.
Figura 2. Variación de la temperatura y la abundancia de fitoplancton promedio diarias en sector los Esteros de la bahía de Manta.
La abundancia de fitoplancton no mostro variación significativa entre el día y la noche. La abundancia promedio 610,7 ± 780,1 cel ml-1. Se registró una correlación positiva entre la abundancia y la temperatura superficial del agua (r= 0,76; p=0,027) (Fig. 3.).
Variación de la temperatura y la abundancia de fitoplancton promedio diarias en sector el Murciélago de la bahía de Manta.
Figura 3.
La comunidad fitoplanctónica estuvo compuesta por 31 familias (Tabla 1). Las diatomeas dominaron en ambos sectores, representando el 71% de las familias en el sector el Murciélago y 91% en el sector los Esteros. Los dinoflagelados siguieron en dominancia en dichos sectores. Las haptofitas y clorofitas solo se detectaron en el sector el Murciélago.
Distribución de grupos taxonómicos en la comunidad fitoplanctónica en dos sectores de la bahía de Manta.
Tabla 1.
|
|
Murciélago |
Los Esteros |
||
|
Grupo |
Nº |
% |
Nº |
% |
|
Diatomeas |
22 |
71 |
10 |
91 |
|
Dinoflagelados |
4 |
13 |
1 |
9 |
|
Haptofitas |
4 |
13 |
|
|
|
Clorofitas |
1 |
3 |
|
|
|
Total |
31 |
|
11 |
|
En el sector el “Murciélago” predominaron las diatomeas de las familias Chaetocerotaceae, Pyxidiculataceae y Lauderiaceae, así como los dinoflagelados de la familia Ceratiaceae y Protoperidiniaceae (Tabla 2). Seis familias representaron el 75,8% de las microalgas en esta localidad.
En contraste, la comunidad de los Esteros estuvo dominada por las familias de diatomeas Chaetocerotaceae, Lithodesmiaceae, Rhopalodiaceae, Melosiraceae y Rhizosoleniaceae así como por dinoflagelados de la familia Ceratiaceae.
Estas seis familias representaron el 82% de las microalgas en dicha localidad.
Representatividad (%) de las familias de fitoplancton observadas en ambas localidades de estudio.
Tabla 2.
|
Familias |
Grupo |
Murciélago |
Esteros |
|
Chaetocerotaceae |
Diatomea |
41,2 |
22 |
|
Lithodesmiaceae |
0,2 |
19,1 |
|
|
Rhopalodiaceae |
- |
10,6 |
|
|
Melosiraceae |
1,1 |
9,2 |
|
|
Rhizosoleniaceae |
2,3 |
6,4 |
|
|
Aulacodiscaceae |
0,2 |
5 |
|
|
Bacillariophyceae |
0,3 |
4,3 |
|
|
Stauroneidaceae |
0,1 |
3,5 |
|
|
Lauderiaceae |
6,4 |
2,8 |
|
|
Coscinodiscaceae |
5,3 |
2,1 |
|
|
Pyxidiculataceae |
7,8 |
||
|
Thalassionemataceae |
5,9 |
||
|
Biddulphiaceae |
2,3 |
||
|
Naviculaceae |
2,1 |
||
|
Amphisoleniaceae |
0,8 |
||
|
Skeletonemataceae |
0,6 |
||
|
Pleurosigmataceae |
0,4 |
||
|
Stephanodiscaceae |
0,4 |
||
|
Ceratocoryaceae |
0,3 |
||
|
Hemidiscaceae |
0,3 |
||
|
Tabellariaceae |
0,1 |
||
|
Radiococcaceae |
0,1 |
||
|
Ceratiaceae |
Dinoflagelado |
9,2 |
14,9 |
|
Protoperidiniaceae |
3,6 |
||
|
Dinophysaceae |
1,1 |
||
|
Cyclococcolithutaceae |
0,3 |
||
|
Pinnularaiceae |
0,04 |
||
|
Discophoerataceae |
Haptophyta |
2 |
|
|
Umbellosphaeraceae |
0,7 |
||
|
Rhabdosphaeraceae |
0,6 |
||
|
Calcidiscaceae |
0,4 |
||
|
Leptocylindraceae |
Chlorophyta |
0,1 |
|
Nueve familias coincidieron entre las comunidades el Murciélago y los Esteros, mientras que 24 familias estuvieron ausentes en este último sector.
Aunque el número de familias en el sector Murciélago fue tres veces superior al de los Esteros, el índice de diversidad H’ estimado para ambas comunidades fue comparable con valores de 3,27 y 3,10 para estos sectores, respectivamente (Tabla 3). La equidad en la comunidad fitoplanctonica de los Esteros se mostró con un índice de homogeneidad mayor (J = 0,90).
Estimaciones de la diversidad en los sectores estudiados en la bahía de Manta.
Tabla 3.
|
|
Murciélago |
Esteros |
|
H' |
3,27 |
3,10 |
|
Hmax |
5,04 |
3,46 |
|
J |
0,65 |
0,90 |
|
Nº |
34 |
11 |
DISCUSIÓN
La bahía de Manta está dividida por el muelle del puerto pesquero que se proyecta aproximadamente mil metros mar afuera. El efecto de esta estructura parece influir de manera importante en los ambientes de los sectores a ambos lados del muelle, pues si bien la temperatura promedio del agua superficial en ambos fue cercana a los 26 ºC, la variabilidad del lado derecho (Los Esteros) fue mucho menor (0,5 ºC) que del lado izquierdo (El Murciélago; 4,6 ºC). Este fenómeno puede estar asociado a que las corrientes predominantes provienen del noreste (Vera et al., 2009) y afectan más intensamente las capas de agua del sector el Murciélago.
La abundancia promedio de fitoplancton en el sector los Esteros fue apreciablemente menor (13,6 ± 4,8 cel ml-1) que en el sector el Murciélago (610,7 ± 780,1 cel ml-1). En ambos sectores se observó una asociación entre la temperatura y la abundancia pues ante los aumentos térmicos el fitoplancton crecía en densidad. Similar resultado encontraron (Ochoa & Tarazona, 2003) en la bahía Independencia, Perú, pues ante pequeños incrementos de temperatura observaron elevaciones en la densidad del fitoplancton.
La diferencia en la abundancia del fitoplancton entre los dos sectores de la bahía de Manta, pudiera atribuirse a diferencias en el nivel de contaminación del agua entre ellos. El sector de los Esteros está afectado por la descarga de hidrocarburos como consecuencia de la cercanía del muelle pesquero, además de la descarga de metales pesados y materia orgánica desdelos ríos Manta y Muerto, tal como reporta Orellana (2008) en su estudio de ambos ríos. Este autor registra valores por encima de la norma (República del Ecuador, 2012) de zinc, níquel, cobalto, cadmio, DBO, DQO y sólidos totales, en las aguas descargadas por estos ríos al sector los Esteros.
Los análisis físico-químicos, si bien es cierto que son de una buena precisión, solo muestran lo expresado en el momento que se capta la muestra de agua, pero los efectos de contaminación se detectan a largo plazo. Es por ello que los resultados son puntuales en el tiempo y no revelan suficientes detalles del efecto que tiene una carga contaminante y la capacidad resiliente de los ecosistemas acuáticos (Santinelli, 2008). Por otra parte, el análisis biótico, como indicadores de afectaciones es mucho más específico para detectar procesos y factores adversos al medio. Las especies presentes en una localidad responden a características ambientales que puedan estar presentes en un determinado momento y que análisis físicos y químicos pueden no detectar (McQuatters-Gollop, Mee, Jan E. Vermaat, & Christoph Humborg, 2008).
Los indicadores biológicos permiten detectar la aparición de elementos contaminantes nuevos.
Ya que es difícil recolectar muestras de todas las especies en la comunidad acuática, es conveniente seleccionar algunas especies que sirvan de indicadoras de condiciones particulares en el ambiente. Esto reduce el costo de evaluar las condiciones en que se encuentra un ecosistema. Por ejemplo, las cianobacterias, debido a su resistencia a condiciones ambientales cambiantes, han sido utilizadas como bioindicadores de contaminación ambiental en ambientes acuáticos (Hanna Mazur-Marzec, Justyna Kobos, & Jussi Meriluoto, s. f.). Igualmente, poliquetos como Capitella spp., son particularmente resistentes a procesos de contaminación orgánica y han sido utilizados como indicadores de deterioro ambiental (Belan, 2003) (Tsutsumi, 1990).
Conforma el fitoplancton un grupo de organismos que reaccionan con celeridad a los cambios físico – químicos en el medio que los contiene, por lo que su uso como bioindicador de estrés a ecosistemas acuáticos resulta idóneo (Dobal et al., 2011). En este sentido, las familias que mostraron mayor abundancia en el ambiente de los Esteros, calificado como más contaminado que el murciélago, pudieran ser consideradas como resistentes a la contaminación. En particular, las diatomeas Chaetocerotaceae, Lithodesmiaceae, Rhopalodiaceae, Melosiraceae y los dinoflagelados de la familia Ceratiaceae.
REFERENCIAS CONSULTADAS
1. Antonio Low Pfeng, & Edward M. Peters Recagno. (2014). LA COMPOSICIÓN QUÍMICA DEL AGUA DEL MAR. Recuperado 27 de julio de 2017, a partir de http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen1/ciencia2/12/htm/sec_16.html
2. Delgado, M. (2007). Playa del Murciélago - Manta - Ecuador. Recuperado 24 de julio de 2017, a partir de http://www.ec.viajandox.com/manta/playa-del-murcielago-A316
3. El Telégrafo. (2015, junio 2). Bacterias tornaron rojas las aguas del río Manta. Recuperado 25 de febrero de 2018, a partir de http://tinyurl.com/y8scobz2
4. F.F. Pérez, & F. Fraga. (1885). Scientia Marina: Investigacion Pesquera. Recuperado 27 de julio de 2017, a partir de http://scimar.icm.csic.es/scimar/index.php/secId/8/IdArt/2233/download.php/Cd/468cc7253061f2e0c3771c8f1462430a/IdArt/2233
5. H. Tsutsumi. (1990). Population persistence of Capitella sp. (Polychaeta; Capitellidae) on a mud flat subject to environmental disturbance by organic enrichment. MARINE ECOLOGY PROGRESS SERIES, 63, 147–156.
6. Hanna Mazur-Marzec, L. parodia, Justyna Kobos, M. P., & Jussi Meriluoto. (s. f.). Hepatotoxinas cianobacterianas, microcistinas y nodularinas, en aguas dulces y salobres de la provincia de Pomerania, norte de Polonia. 2008-01-05, 37(4), 21.
7. Jimenez Roberto. (1983). Acta Oceanografica Del Pacifico (2nd. Edicion). GUAYAQUIL. Recuperado a partir de http://www.inocar.mil.ec/web/index.php/publicaciones/category/3-acta-oceanografica-del-pacifico-vol-2-n-1-1983?limitstart=0
8. L.Vera, M. Lucero, & M. Mindiola. (2009). CARACTERIZACIÓN OCEANOGRÁFICA DE LA COSTA CENTRAL ECUATORIANA ENTRE LA PUNTA DEL MORRO Y JARAMIJÓ, ECUADOR, 15(1), 17.
9. McQuatters-Gollop, A. J. G. A., Mee, L. D., Jan E. Vermaat, Y. A., & Christoph Humborg, F. W. (2008). How well do ecosystem indicators communicate the effects of anthropogenic eutrophication? 16/02/2009, 82(1), 583–593.
10. N. Ochoa, & J. Tarazona. (2003). Variabilidad temporal de pequeña escala en el fitoplancton de bahía independencia, Pisco, Perú, 10, 66.
11. Naranjo, C., & Tapia, M. E. (2013). VARIABILIDAD ESTACIONAL DEL PLANCTON EN LA BAHÍA DE MANTA EN LA COSTA ECUATORIANA, DURANTE EL 2011. ACTA OCEANOGRÁFICA DEL PACÍFICO, 18(N° 1, 2013), 10.
12. Nuñez, A., Elizabeth, M., Zambrano, H., & Monica, C. (2010). Caracterización y propuesta tecnica de la acuicultura en el canton manta. Recuperado a partir de http://www.dspace.espol.edu.ec/handle/123456789/10400
13. Pedro Orellana Izquierdo. (2008). DIAGNOSTICO AMBIENTAL DE LA CUENCA DEL RIO MANTA DESDE EL SECTOR DE LAS LAGUNAS DE ESTABILIZACIÓN, HASTA LA CONFLUENCIA DE LOS RIOS MANTA Y BURRO. Universidad Internacional SEK, Manta.
14. PIELOU. (1969). An Introduction to Mathematical Ecology. Wiley-Interscience.
15. Prado, M., Bucheli, R., & Caldeón, G. (2016). Composición, distribución y abundancia del plancton en sistemas fluviales de la provincia Los Ríos-Ecuador. ResearchGate. Recuperado a partir de https://www.researchgate.net/publication/305347371_Composicion_distribucion_y_abundancia_del_plancton_en_sistemas_fluviales_de_la_provincia_Los_Rios-Ecuador
16. R. Sokal F. Rohlf. (2011). Biometry (4a). Freeman & Co.
17. Republica del Ecuador. (2012). TEXTO UNIFICADO DE LEGISLACION SECUNDARIA, MEDIO AMBIENTE, PARTE 4. Decreto Ejecutivo 3516.
18. Santinelli, N. H. (2008). Fitoplancton de un ambiente costero sometido a perturbación antrópica: Bahía Nueva, provincia de Chubut. Recuperado a partir de https://www.oceandocs.org/handle/1834/3547
19. Shannon, and Weaver. (1949). The Mathematical Theory of Communication. University Illinois Press. Recuperado a partir de http://www.fcnym.unlp.edu.ar/catedras/ecocomunidades/TPN3Diversidad.pdf
20. Soler, C., Carmen Fuentes, M. del, Sancho, M., García, A., de Murga, M. N., & de Murga, J. N. (2012). Efecto de la cámara de recuento utilizada sobre los parámetros espermáticos, analizados con el ISASv1®. Revista Internacional de Andrología, 10(4), 132–138. https://doi.org/10.1016/S1698-031X(12)70069-9
21. T.A.Belan. (2003). Benthos abundance pattern and species composition in conditions of pollution in Amursky Bay (the Peter the Great Bay, the Sea of Japan).
22. Telégrafo, E. (2016, sabado, de abril del). Manta, punto clave para el turismo en Manabí. Recuperado 24 de julio de 2017, a partir de http://www.eltelegrafo.com.ec/noticias/regional-manabi/1/manta-punto-clave-para-el-turismo-en-manabi
23. Telégrafo, E. (2017, enero 14). Lagunas de oxidación son mejoradas. Recuperado 25 de febrero de 2018, a partir de https://www.eltelegrafo.com.ec/noticias/regional-manabi/1/lagunas-de-oxidacion-son-mejoradas
24. V. Dobal, S. L., & G.M. Lugioyo. (2011). Potential of planktonic cyanobacteria as bioindicators of environmental stress in coastal ecosystems.
REFERENCES CONSULTED
1. Antonio Low Pfeng, & Edward M. Peters Recagno. (2014). THE CHEMICAL COMPOSITION OF SEA WATER. Retrieved July 27, 2017, from http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen1/ciencia2/12/htm/sec_16.html
2. Delgado, M. (2007). Playa del Murciélago - Manta - Ecuador. Retrieved July 24, 2017, from http://www.ec.viajandox.com/manta/playa-del-murcielago-A316
3. The Telegraph. (2015, June 2). Bacteria turned the waters of the Manta river red. Retrieved February 25, 2018, from http://tinyurl.com/y8scobz2
4. F.F. Pérez, & F. Fraga. (1885). Scientia Marina: Fisheries Research. Retrieved July 27, 2017, from http://scimar.icm.csic.es/scimar/index.php/secId/8/IdArt/2233/download.php/Cd/468cc7253061f2e0c3771c8f1462430a/IdArt/2233
5. H. Tsutsumi. (1990). Population persistence of Capitella sp. (Polychaeta; Capitellidae) on a mud flat subject to environmental disturbance by organic enrichment. MARINE ECOLOGY PROGRESS SERIES, 63, 147–156.
6. Hanna Mazur-Marzec, L. parody, Justyna Kobos, M. P., & Jussi Meriluoto. (s. f.). Cyanobacterial, microcystin and nodularin hepatotoxins, in fresh and brackish waters of the Pomeranian province, northern Poland. 2008-01-05, 37 (4), 21.
7. Jimenez Roberto. (1983). Oceanographic Record of the Pacific (2nd. Edition). GUAYAQUIL. Recovered from http://www.inocar.mil.ec/web/index.php/publicaciones/category/3-acta-oceanografica-del-pacifico-vol-2-n-1-1983?limitstart=0
8. L. Vera, M. Lucero, & M. Mindiola. (2009). OCEANOGRAPHIC CHARACTERIZATION OF THE ECUADORIAN CENTRAL COAST BETWEEN THE PUNTA DEL MORRO Y JARAMIJÓ, ECUADOR, 15 (1), 17.
9. McQuatters-Gollop, A. J. G. A., Mee, L. D., Jan E. Vermaat, Y. A., & Christoph Humborg, F. W. (2008). How well do ecosystem indicators communicate the effects of anthropogenic eutrophication? 02/16/2009, 82 (1), 583–593.
10. N. Ochoa, & J. Tarazona. (2003). Small-scale temporal variability in the phytoplankton of Bahía Independencia, Pisco, Peru, 10, 66.
11. Naranjo, C., & Tapia, M. E. (2013). SEASONAL VARIABILITY OF THE PLANCTON IN THE BAHÍA DE MANTA ON THE ECUADORIAN COAST, DURING 2011. PACIFIC OCEANOGRAPHIC ACT, 18 (No. 1, 2013), 10.
12. Nuñez, A., Elizabeth, M., Zambrano, H., & Monica, C. (2010). Characterization and technical proposal of aquaculture in the Manta canton. Recovered from http://www.dspace.espol.edu.ec/handle/123456789/10400
13. Pedro Orellana Izquierdo. (2008). ENVIRONMENTAL DIAGNOSIS OF THE MANTA RIVER BASIN FROM THE STABILIZATION LAKES SECTOR, UNTIL THE CONFLUENCE OF THE MANTA AND DONKEY RIVERS. SEK International University, Manta.
14. PIELOU. (1969). An Introduction to Mathematical Ecology. Wiley-Interscience.
15. Prado, M., Bucheli, R., & Caldeón, G. (2016). Composition, distribution and abundance of plankton in river systems of the Los Ríos-Ecuador province. ResearchGate Recovered from https://www.researchgate.net/publication/305347371_Composicion_distribucion_y_abundancia_del_plancton_en_slumes_fluviales_de_la_provincia_Los_Rios-Ecuador
16. R. Sokal F. Rohlf. (2011). Biometry (4th). Freeman & Co.
17. Republic of Ecuador. (2012). UNIFIED SECONDARY LEGISLATION, ENVIRONMENTAL TEXT, PART 4. Executive Decree 3516.
18. Santinelli, N. H. (2008). Phytoplankton of a coastal environment subjected to anthropic disturbance: Bahía Nueva, province of Chubut. Recovered from https://www.oceandocs.org/handle/1834/3547
19. Shannon, and Weaver. (1949).The Mathematical Theory of Communication. University Illinois Press. Recovered from http://www.fcnym.unlp.edu.ar/catedras/ecocomunidades/TPN3Diversidad.pdf
20. Soler, C., Carmen Fuentes, M. del, Sancho, M., García, A., de Murga, M. N., & de Murga, J. N. (2012). Effect of the counting chamber used on sperm parameters, analyzed with the ISASv1®. International Journal of Andrology, 10 (4), 132-138. https://doi.org/10.1016/S1698-031X(12)70069-9
21. T.A. Belan. (2003). Benthos abundance pattern and species composition in conditions of pollution in Amursky Bay (the Peter the Great Bay, the Sea of Japan).
22. Telegraph, E. (2016, Saturday, April, April). Manta, key point for tourism in Manabí. Retrieved July 24, 2017, from http://www.eltelegrafo.com.ec/noticias/regional-manabi/1/manta-punto-clave-para-el-turismo-en-manabi
23. Telegraph, E. (2017, January 14). Oxidation gaps are improved. Retrieved February 25, 2018, from https://www.eltelegrafo.com.ec/noticias/regional-manabi/1/lagunas-de-oxidacion-son-mejoradas
24. V. Dobal, S. L., & G.M. Lugioyo (2011). Potential of planktonic cyanobacteria as bioindicators of environmental stress in coastal ecosystems.
©2019 por los autores. Este artículo es de acceso abierto y distribuido según los términos y condiciones de la licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional (CC BY-NC-SA 4.0) (https://creativecommons.org/licenses/by-nc-sa/4.0/).